Доброго времени суток всем. На Пикабу частенько всплывают посты о крафте с применением эпоксидки и люминофора. Выглядит красиво и эффектно, обычно используются сульфидные (кристаллические) люминофоры, ибо технология их производства давно отлажена и они имеют отличные показатели длительности и интенсивности свечения, но здесь речь пойдет вовсе не о них. Прежде всего стоит уяснить что фигурирующее в названии поста слово "витроидальный" значит примерно то же что и аморфный. По сути речь идет о способных к послесвечению стеклах, но стеклах необычных.
Витроидальные люминофоры (обычно на основе оксида бора) не находят широкого применения, и это понятно, по всем характеристикам они значительно уступают классическим кристаллофосфорам, есть у них и плюсы, но обо все по порядку.
Около года назад пришлось подробно вникать в эту тему ввиду выполнения небольшой научной работы, были получены интересные практические результаты которыми и хочется поделиться. Главное (но не единственное) преимущество борного люминофора - ужасающе низкий порог вхождения. Кое-что можно сделать буквально на коленке. Собственно примитивные вариации на тему изготовления люминофоров уже всплывали на Пикабу, но как известно нет придела совершенству.
В примитивном случае для изготовления люминофора Вам понадобится алюминиевая (или фарфоровая емкость), несколько грамм борной кислоты из аптеки, салициловый спирт, газовая плита и в меру кривые руки. Кислота помещается в "тигель" пропитывается салициловым спиртом, после чего "тигель" медленно нагревается до плавления массы. После остывания получите желтоватое стекло которое будет светиться синим в УФе и даже обладать некоторым послесвечением (доли секунды).
Эффект достигнут дальше дело технологии, но она и играет здесь главную роль. Главный вопрос, в каких пропорциях мешать? Литература, в лице еще довоенной книги Жирова "Люминофоры (светящиеся твердые составы)" рекомендует соотношение матрицы (в данном случае борная кислота) и активатора (самые разнообразные вещества, но в данном случае, салициловая кислота) около 30000:1, в других источниках можно найти разброс "оптимальных" соотношений от 1000:1 до 50000:1, разница в 50 раз! Кому верить?
Или как проверить? Было изготовлено несколько серий стекол с разной концентрацией активатора. Методика здесь играет решающую роль, но об этом чуть позже, пока поговорим о том как сравнивать люминофоры. Тут для меня было "не паханое поле", ибо литературные источники либо скромно умалчивают о яркости либо обходятся формулировками типа "яркий", "средний", "тусклый". Ситуацию надо было срочно исправлять, тут как всегда, на помощь приходит паяльник и Arduino. Был зарукожплен аппарат гордо названый "Спектрограформ затухания".
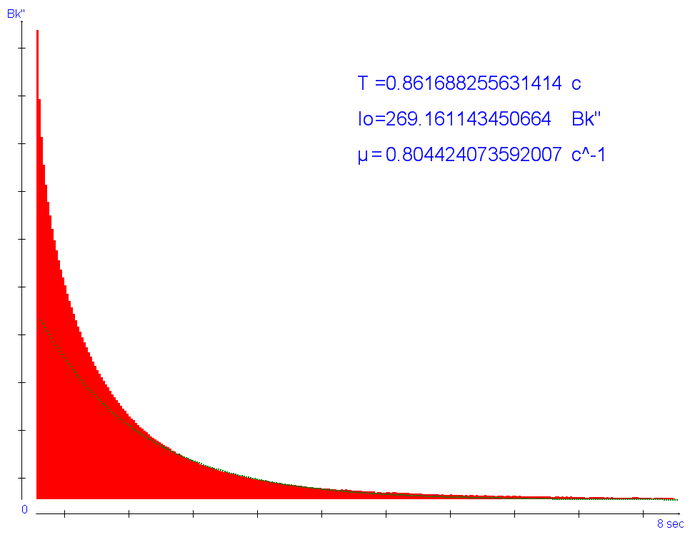
Шайтан машин получился чувствительным и для нормальной его работы требуется темная комната и чехол из плотной ткани. О его устройте и программной начинке нужен отдельный пост, но суть в том что образец через систему линз облучается светом, после чело его яркость измеряется фотоэлементом на протяжении некоторого отрезка времени. Ардуина делат много замеров, вносит необходимые расчеты и поправки, все это долго и скучно, но на выходе мы имеем два важных чиста. Время полузатухания люминофора и его аппроксимируемая начальная светимость. И если с первым числом все понятно (время за которое яркость образца снижается в двое), то со вторым пришлось вкуривать много математики и статистики. Все дело в том что напрямую измерить яркость образцов невозможно, фотоэлемент (как, впрочем, и глаз наблюдателя) в начальный момент засвечен светом от источника которым производилась "зарядка" люминофора. Через некоторое время (0.1-0.3с) мы получаем адекватные данные, но все люминофоры затухают по разному! Один отдает всю энергию за 0.5 секунды и светит как фонарь, другой светит часами, но еле различим. Тут, опуская математические выкладки, учитывая что люминофоры затухают по логарифмическому закону для множества "точек" яркости может быть выведена зависимость - функция индивидуально характеризующая люминофор их которой может быть получена та самая "светимость нулевого момента". Я понимаю что предыдущий текст сложен для восприятия, для тех кто не понял - это просто "яркость".
Визуально получаемые данные можно наблюдать на следующей пикче, где красное есть данные поступающие с датчика, а зеленая прямая - та самая "кривая затухания" после всех программных поправок.
Ну да ладно. Это все лирика. Какой профит был получен? После нескольких сотен прогнанных через фанерное чрево спектроскопа образцов была установлена зависимость той самой "яркости нулевого момента" (читай качества образца) от концентрации активатора. Графики здесь прикладывать смысла нет ибо они логарифмические и малоинформативны для людей не искушенных. Сразу скажу оптимум, как оказалось, понятие растяжимое. Люминофоры наивысшего качества (активатор флуоресцеин) получаются при разбросе концентраций активатора от 1:5000 до 1:50000. В этих приделах получаются образцы очень яркие в первые несколько секунд свечения (сравнимо с яркостью источника которым они были возбуждены) после свечение уменьшается и уже через 5-10 минут совершенно не заметно для глаза. Наилучшие результаты обычно достигаются с флуоресцеином в качестве активатора. При активации салициловой кислотой ситуация отстоит схожим образом, оптимум простирается от 1:1000 до 1:50000, причем яркость образца очень резко падает если использовать больше активатора. Главная ошибка всех кто делает борные люминофоры - хроническое завышение количества активатора и это ясно, интуитивно не понятно как столь мизерное количество активатора может оказать влияние на свойства? Как его вообще вносить в столь малых количествах? Но это вопрос технологии, о ней далее.
Для всех этих исследований потребовалось выработать технологию которая бы давала постоянный результат, ибо при изготовлении "на коленке" как это обычно рекомендуют в интернете многое зависит от везения. Если Вы хотите получить нормальный люминофор первое о чем следует озаботиться это чистота применяемых реактивов. Борную кислоту желательно несколько раз перекристаллизовать из дистиллята, так же поступаем с активатором. Нагрев должен быть как можно более равномерным. Этого можно достичь по разному, я применял массивный стальной тигель на песчаной бане, дно которого было услано алюминиевой фольгой. Контакт расплава с железом и прочим мусором недопустим, металлы сами по себе могут служить активаторами, но обычно они предпочитают полностью подавлять послесвечение.
Теперь о внесении активатора. Активатор я вносил в виде растворов в дистилляте. Я думаю все представляют как приготовить 1% раствор чего-либо, поле этот раствор разбавляется в нужное число раз и вносится в тигель куда предварительно была перенесена навеска борной кислоты. Таким образом я готовил люминофоры с поистее гомеопатическим содержанием активатора 1:500000 и сам факт их интенсивного (хотя и не идеального) послесвечения крайне интересен. После внесения активатора, смесь высушивается и начинается ее плавный нагрев до 200С, тут важно не перегреть и четко контролировать температуру. Повышение до 300С, не критично но результаты будут скромнее. После полного расплавления кислоты ее нужно как можно скорее извлечь из тигля во избежание кристаллизации (это не трудно сделать если тигель услан фольгой). Поле остывания люминофор можно измельчить (но без фанатизма, трибоэффект имеет место быть) следует предупредить что люминофор сильно боится воды, его следует хранить в герметичной таре или, прибегнуть к следующей хитрости: смочить измельченный люминофор раствором парафина в бензине, после высыхания он будет полностью гидрофобен. В случае с заливкой в эпоксидную смолу проблема защиты люминофора от влаги полностью отпадает.
Да будет свет! Больше света!