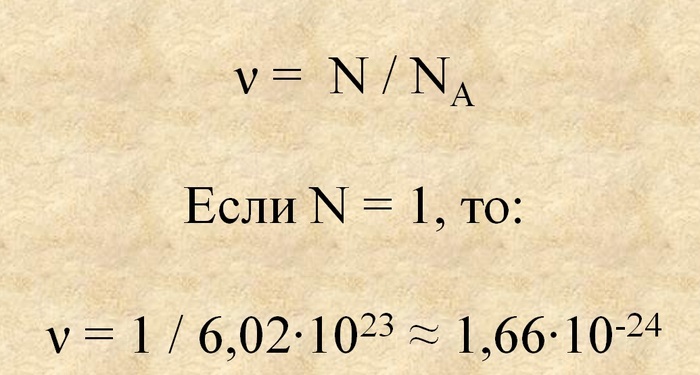Вопрос о единицах измерения тех или иных величин довольно важен. Все знают, что расстояние измеряют в метрах, время в секундах, а количество в штуках. И пока мы говорим о количестве землекопов, бывших жён или спичек в спичечном коробке, всё предельно понятно и просто. Однако, как только речь заходит о количестве вещества, начинаются проблемы. Поговорим об этом немного подробнее.
Что мы можем сказать о такой величине как количество? Думаю, очевидно, что количество чего-то не может быть отрицательным. Также количество всегда выражается целым числом. Конечно, мы можем говорить, например, про четверть пиццы или полтора яблока, но, зачастую, часть предмета не может выполнять функций целого предмета, как например половина землекопа не может копать траншею или четверть зонта спасти вас от дождя. Когда мы говорим об атомах, молекулах или ионах, то здесь работает точно такая же логика — число таких частиц должно быть целым неотрицательныйм числом. Однако, в химии, для измерения количества, вместо штук используется такая величина, как «моль». Почему? Давайте разбираться.
Для любителей смотреть и слушать предлагаю видеоформат:
Для любителей текстовых вариантов — текстовый формат:
Хоть представления о том, что материя состоит из очень маленьких дискретных частиц, сформировалось ещё в древней Греции, подтвердить это экспериментально удалось много позднее. Одним из основных доказательств дискретности материи служил тот факт, что вещества взаимодействуют между собой в определённых массовых соотношениях. Это можно было объяснить, например, тем, что вещество состоит из частиц, которые взаимодействуют друг с другом в определённом количественном соотношении. А так как масса каждого типа частиц одинаковая, то количественное отношение взаимодействующих частиц должно быть равно отношению массовому.
В силу того, что исследователи того времени не обладали инструментами для того, чтобы хотя бы примерно оценить массы или размеры самих частиц, было решено использовать массовые отношения в качестве аналога количества. Первая попытка создания таблицы с относительными массами принадлежит Джону Дальтону. В 1803г. он предлагает таблицу, в которой относительные атомные массы элементов выражены через массу атома водорода. То есть, если атом водорода весит одну некую условную единицу массы, тогда кислород весит примерно 16, углерод 12 и так далее. Эту условную единицу стали называть «атомной единицей массы» (а.е.м.) или, в честь учёного, который её ввёл — Дальтоном (Да).
Однако, в силу того, что получить чистый водород, а уж тем более работать с ним, по тем временам было довольно сложно, в 1818г. Берцеллиус предлагает кислородную шкалу, где за эталон массы принимается уже атом кислорода, относительная масса которого была принята за 103. Система Берцеллиуса больше пришлась по душе мировому научному сообществу и являлась основной на протяжении практически 50 лет. В 1860х годах мода сменилась, и учёные вновь перешли на водородную систему, а в начале XX века вернулись к кислородной шкале. Но теперь за атомную единицу массы брали массу, равную 1/16 массы атома кислорода. И водородная и кислородная шкалы имели как достоинства, так и недостатки. Особенно учитывая то, что после открытия различных изотопов (атомов одного и того же химического элемента с разной массой) кислорода, существовало две кислородные шкалы — по массе чистого изотопа кислорода 16 и по средней массе кислорода.
Существование нескольких шкал в науке всегда не приветствовалось и в 1960м году учёные окончательно утвердили шкалу, по которой будут определяться массовые соотношения. Этой шкалой стала углеродная шкала, а 1 а.е.м стала строго равна 1/12 массы изотопа углерода 12. Причины такого решения — это тема для отдельного поста.
То есть, по сути, химики оперируют не количеством конкретного вещества, а лишь относительной массой частиц этого вещества. Но что же тогда такое «моль» и откуда он взялся?
Термин «моль» появился в 1897 году как тупой перевод некой единицы «mol», придуманной в 1894 году Оствальдом как сокращение слова «молекула».
А его использование в современном понимании началось как раз после принятия углеродной шкалы. В силу того, что атомные единицы массы были величинами относительными и безразмерными, было решено привязать их к реальным массам. Так как наиболее удобными массами для работы в лаборатории являются величины порядка грамма, за эталон количества, которое стали именовать «моль», взяли величину, численно равную количеству атомов которое содержится в 12 граммах чистого вещества, состоящего из изотопа углерода 12. То есть, по сути, моль — это величина, которая связывает граммы и относительные атомные единицы массы. Число частиц в одном моле вещества постоянно и именуется числом Авогадро. Авогадро, к слову, численно эту величину не выводил и вообще к этой концепции имеет косвенное отношение. Он лишь утверждал, что при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое количество молекул. Это утверждение послужило началом к установлению численного значения количества частиц в одном моль вещества.
Не будем подробно останавливаться на методах определения этой величины, скажем лишь, что изначально она определялась при помощи постоянной Больцмана и свойств реальных газов. Численно эта величина равна порядка 6,02*10^23 штук в 1 моль вещества (более точное значение легко можно отыскать в интернете).
Вот, наконец, мы и пришли к штукам, о которых говорили изначально. Однако, стоит понимать, что эти штуки довольно условны. И здесь в ход вступает уже точности определения как самих масс, так и числа Авогадро, а так же квантовые эффекты.
По сути, если мы предположим, что у нас будет теоретическая возможность с максимальной точностью накладывать на весы атомы углерода, то их масса может и не быть равна строго 12 граммам. Но, в силу того, что у нас нет (и в ближайшее время не предвидится) аппаратуры с такой точностью, мы всегда можем говорить о количестве как «В одном моль вещества содержится что-то около 6,02*10^23 частиц».
С другой стороны, раз моль — это не штуки, а кучи штук, то выражение количества вещества через моли допускает дробные значения. То есть полторы штуки атомов — это недопустимо, а вот полтора моль — вполне допустимо.
Ну и раз уж мы заговорили о численных границах, давайте попробуем найти минимальное значение, которое может иметь такая величина как «моль». Для этого мы возьмём обратное значение постоянной Авогадро или 1/6,02*10^23. В результате получим что-то около 1,66*10^-24.
Отсюда получается, что количество вещества, которое меньше данной величины считается сугубо математическим, и к реальности не будет иметь никакого отношения. Конечно, мы могли бы сказать, что количество вещества также должно быть кратно полученному значению, но в силу больших погрешностей, а так же не полном соответствии числа Авогадро реальному числу частиц в какой-нибудь системе, это соответствие установить строго невозможно.
• На самом деле, химики используют не количество вещества, а лишь относительные массовые порции этого вещества.
• Моль — это всего лишь величина, связывающая реальную массу вещества с её относительной массой по углеродной шкале.
• Один моль содержит не строгое количество частиц, а лишь приблизительное, с некоторыми допущениями и ограниченное точностью аппаратуры на которой оно измерено.
• Количество, выраженное в молях может иметь дробное значение.
• Количество вещества, которое имеет порядок -25 и ниже не может существовать в реальном мире.