Немного химии 3
В последней части расскажу про устройство химической связи, в продолжение вот этого поста
http://pikabu.ru/story/nemnogo_khimii_2_5084796
После изобретения валентности в 1825 году, практически не происходило никаких движений в объяснении природы химической связи. Теория стала появляться чуть запаздывая, за аналогичным пониманием строения атома.
Вслед за планетарной теории атома, Льюис предложил электронную теорию химической связи, он её развивал с 1912-1916 год. Если вы нарисуете рядом два массивных ядра, то увидите, что самое "желанное" место у электрона, который имеет отрицательный заряд, будет между двумя положительно заряженных ядер. Ковалентная химическая связь, по Льюису, образуется за счёт обобществления пары электронов.
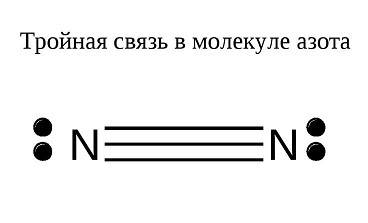
Все наверное рисовали в школе подобные картинки. Преподавание химии повторяет историю химии, и это первое что рисуют в школе.
Каждая точка на рисунке, это электрон. Если он находится между атомами, то его считают общим, пара общих электронов образует одинарную связь. В итоге, пару общих электронов записывают как "палочку" что нагляднее. В молекуле азота, становятся общими 6 электронов, по 3 от каждого.
При этом считается, что атомы стремятся получить 8 электронов(за счет общих), что было названо правилом октета.
Эта теория очень проста, но подобные изображения и сейчас используются химиками, особенно много её используют органики, хотя бывают случаи, когда подобными обозначениями нельзя что-то объяснить вообще, нужны теории помощнее.
Пример использования структурной формулы в химии(название реальное, скрин из статьи сделал)
Переломным моментом настал 1926 год, когда появилась на свет квантовая механика. Вместе с понятиями электронной плотности, и волновой функции появились новые теории.
В 1927 году В. Гайтлером и Ф. Лондоном была рассчитана энергия связи в молекуле водорода, это классическая научная работа, которая приводится во многих учебниках по строению молекул. Их энергия связи получилась намного меньше экспериментальной (их решение в итоге улучшили, и получили полную сходимость с экспериментом). Оказалось, что электронная плотность, не так уж и сильно скапливается между атомами, а вот спины валентных электронов спариваются, и в итоге, пара электронов начинает принадлежать всей молекуле, и как бы стягивает ядра. Так появилась теория валентных связей.
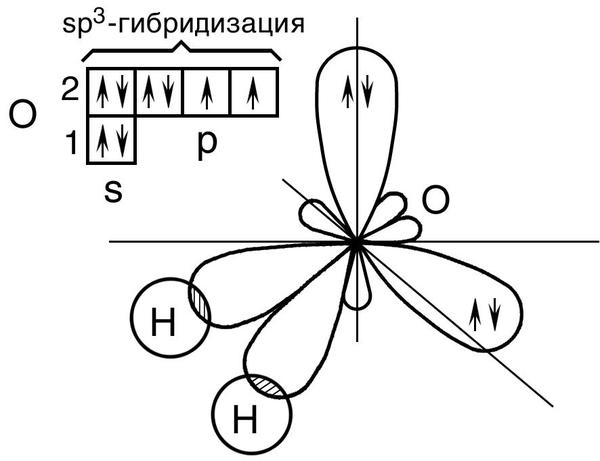
В 1931 году к этой теории Полинг добавил важную достройку - гибридизацию орбиталей.
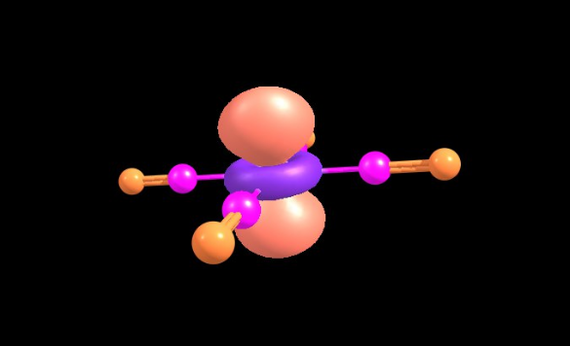
Это гипотетический процесс смешивания валентных орбиталей у атомов, который позволяет объяснить геометрию молекул. Например для воды, центральный атом кислорода имеет 4 орбитали s и три разных p. Их смешивание, дает нам 4 одинаковых по форме, но разные по направлению орбитали. Две из них перекрываются с орбиталями атомов водорода, а на двух других остаются по паре электронов кислорода.
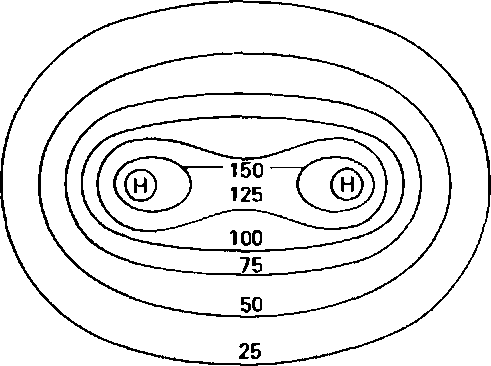
Хочется представить, что у воды торчат "уши" в виде электронных пар, но я не зря выделил слово гипотетический. Добавлю картинку с рассчитанной электронной плотностью H2O
Никаких ушей нет. Сферическая попка.
Еще одна надстройка к описанию молекул, появилась благодаря квантомеханическому постулату суперпозиции. Этот постулат говорит, что система может находиться одновременно в нескольких состояниях, что не наблюдается в классической механике(хотя классическая механика является частным случаем квантовой, всё из-за эффекта наблюдателя, который я обсуждал в другом посте).
Полинг ввел теорию резонанса, хотя похожие на неё вещи обсуждались намного раньше. Она утверждает, что реальное электронное строение молекулы, представляет из себя сумму всевозможных канонических структур (структуры с палочками в виде общих пар), каждая из которых имеет разный вклад в общую, совсем бредовые например не пишут, так как их вклад безумно мизерный.
Эти две резонансные формулы имеют самый большой вес в описании электронного строения бензола. Именно этим объясняется одинаковая длина и энергия связей C-C в молекуле бензола. Конечно можно учесть и другие резонансные формы.
Но их вклад намного меньше. Особенно полезна теория резонанса в органической химии. Эти три теории вместе, используются в большинстве описаний процессов, ибо не сложнее чем на пальцах.
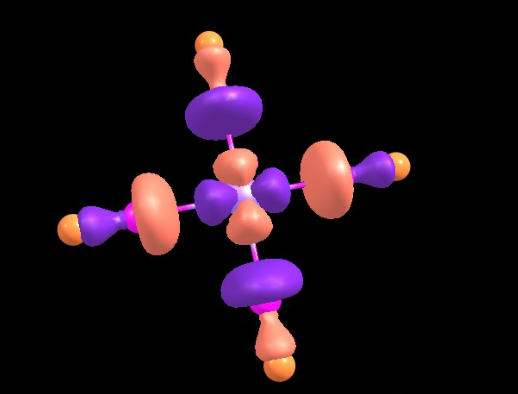
Но некоторые химические и физические свойства нельзя описать и даже с помощью резонанса. Ближе всего к реальному описанию через волновую функцию, лежит метод молекулярных орбиталей. Дело в том, что у молекул, как и у атомов, можно ввести приближение электронных орбиталей. В отличие от атомных орбиталей, последние размазаны по всей молекуле, и их точную форму невозможно найти(уравнение не имеет аналитического решения), но сколько-угодно точное решение найти мы можем(правда придется потратить много процессорного времени для этого, чем точнее тем больше). Чтобы не усложнять себе жизнь, берется самое простое упрощение: молекулярные орбитали представляют из себя какую-то линейную комбинацию атомных. Получаемые орбитали имеют энергию отличную от исходных атомных, количество их сохраняется. Из 2 атомных получатся 2 молекулярные, из 30 атомных, 30 молекулярных, и так до бесконечности...Правила построения таких орбиталей сложнее чем построения предыдущих теорий, и требуют небольших знаний теории групп.
Тут пойдут картиночки орбиталек. Это несколько орбиталей [Ni(CN)4]2-
А на этом сайте можно покрутить орбитали бензола.
http://lampx.tugraz.at/~hadley/ss1/molecules/Benzene/Benzene...
Этот метод позволил объяснить как получаются трехэлектронные двухцентровые связи, или трехцентровые четырехэлектронные(у Льюиса всегда только два электрона и два атома на одну связь), магнитные свойства(например кислород парамагнитен, и притягивается магнитом),химические соединения благородных газов Kr и Xe, различные "нарушения" валентности, а так же закономерности в окраске соединений.
Вот такие пироги.