В этом посте я расскажу о современных взглядах на атом. Но прежде чем начать, хочу отметить интересный факт.
Если вы читали прошлый пост, то видели, что в 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии». Так вот, дело в том, что название «гомеопатия» было предложено Самуэлем Ганеманом (1755—1843) в конце 1807 года. Тут не удивительно, что Ганеман не понимал в чём проблема огромных разбавлений, да и вообще всей идеи гомеопатии. Получается, что через год после своего названия, гомеопатия уже стала противоречить науке. А гомеопаты утверждают о большой истории. Да-да, большая история лженауки.
Стандартные картиночки с сайта с объяснением действия гомеопатии:
Доказать наличие молекул на то время было очень сложно, они очень малы. Чтобы вы понимали насколько, покажу простейший расчет.
В видимой части вселенной порядка 10^24 звезд, если поставить каждой звезде одну молекулу воды, то объем воды будет
10^24*18/6.02E23/1,0=29,90 мл или полторы столовые ложки.
Физики объясняли(математически) эффекты преломления света и рассеивания в диэлектриках с помощью уравнений, которые предполагали, что в материи есть осциллирующие заряды. Это могло означать, что атомы это зарядовые осцилляторы с собственными частотами. Но почему тогда они не излучают свет сами, как требуют того уравнения Максвелла, и что за заряды в атоме, из чего он состоит?
Всё прояснилось в 1897 году, когда установили, что катодные лучи состоят из частиц с одинаковым отрицательным зарядом. Их назвали электронами. И они точно были в составе атома, но в виде чего?
Первая модель атома, называется "Пудинг с изюмом"
С точки зрения Томсона:
атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд.
Если что, я нарисую квадратную сферу.
Самое любопытное, что в чём-то он был прав. У него появилась идея о плотности заряда(только вот он перепутал где что)
Но эта модель была опровергнута в эксперименте по рассеянию альфа-частиц на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году, предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда.
Вот видео о модели рассеяния
Модель Резерфорда тоже имела недостатки, дело в том, что движение заряда по орбите, будет вызывать электромагнитные волны, которые унесут энергию электрона, и он непременно упадет на ядро.
Для объяснения стабильности атомов, Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда») Это очень грубая теория. Безумно грубая. Но для атома водорода она дала верное значение, но для любых других атомов давала ошибку, и химическую связь объяснить тоже не смогла.
Всё изменилось только после развития квантовой механики, уравнение Шредингера примененное к атомам, давало очень точные результаты, только вот оно имело аналитическое решение лишь для атома водорода. Да и то довольно громоздкое.
Но из него следовали потрясающие следствия. Дело в том, что электрон как бы размазан всюду. Всюду -означает буквально везде, вероятность найти этот электрон существует буквально везде во вселенной, только вот крайне быстро падает с расстоянием.
Электрон не излучает, так как и не движется будто, он "размазан" по всему атому. (вспомните модель булочки с изюмом)
Еще, электрон может находиться на определенных уровнях энергии.Это объясняло дискретный вид спектров излучения различных атомов. Эти уровни в честь орбит, назвали орбиталями, причем на некоторых, электрон имеет момент импульса, будто бы вращается, но это проявляется только в магнитных эффектах, так как "вращается" всё облако сразу, а заряд при этом не меняет своего распределения.
Структура таблицы Менделеева стала понятна, номер элемента в таблице это заряд ядра. А периодичность свойств, это проявление заполнения орбиталей электронами.
Хоть уравнение Шредингера для многоэлектронных атомов решить нельзя, общие принципы можно обозначить в простейших правилах, которые все учат в школе или в университетах на первом курсе. Расписывать подробно не стану, лишь упомяну их. Найти их можно в любом учебнике химии от 9 класса и старше.
1. Принцип наименьшей энергии.
2. Правило запрета Паули
3. Правило Хунда
Это простые правила, которые без расчетов, простейшей арифметикой дают способ узнать электронное строение большинства атомов в таблице Менделеева.
Об этом рассказывают в школах, но даже сейчас школьники говорят что электрон "вращается" вокруг ядра, как ни странно.
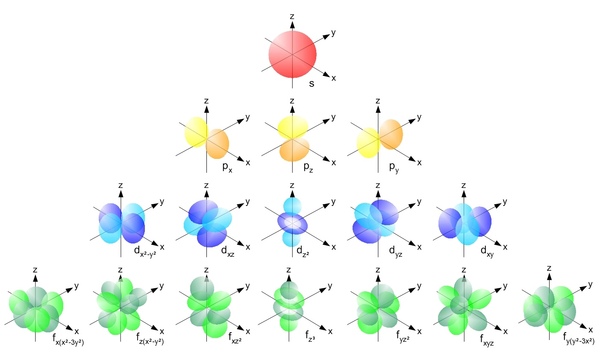
А вот формы орбиталей в атоме водорода. В других атомах они очень близки к водородным.
Стоит еще сказать о размерах атома. Дело в том, что размер ядра в 10000 раз меньше, чем размер атома. А большую часть массы атома, составляет именно масса ядер. Если ядро атома увеличить до размера горошины, то сам атом должен будет быть, размером с Останкинскую телебашню. Мы на огромную свою часть пустые. (именно поэтому для радиации мы прозрачны)
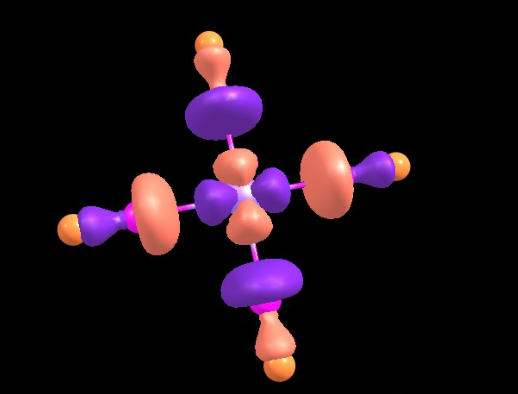
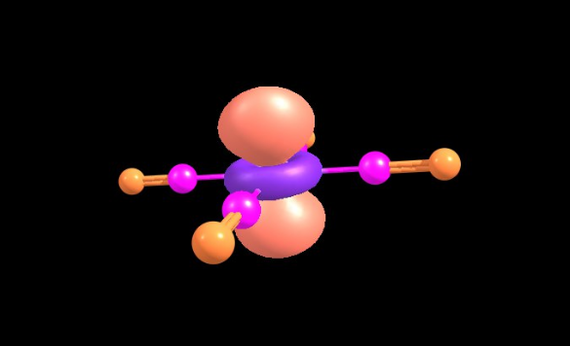
Представления о химической связи прошли очень близкий путь со строением атома, но имели свои особенности. О хим. связи, видах связей и современном понимании я расскажу в следующем посте. Будут веселые картинки молекулярных орбиталей, которые я получил на компьютере, типа таких